الحل
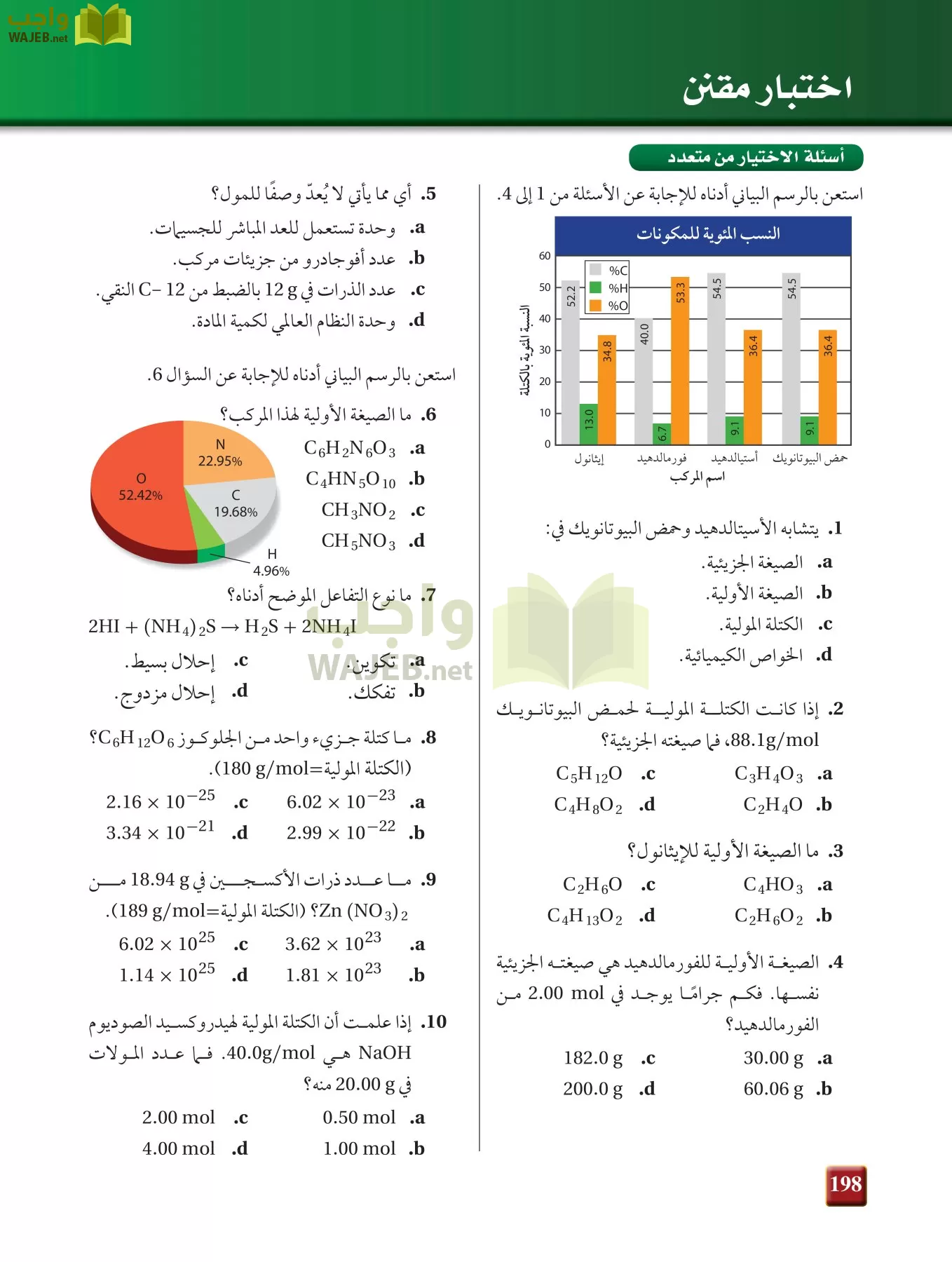
مادة كيمياء 1
مسائل تدريبية
74) يظهر في الشكل المجاور تركيب احد الاملاح المائية فما صيغه هذا الملح المائي ؟ ومااسمه ؟
الكتلة المولية :
عدد المولات :
قسمة مولات الماء علي مولات الملح :
نكتب صيغة الملح المائي :
75) تحفيز سخنت عينه كتلتها 11.75 g من ملح مائى شائع لكلوريد ll وبقى بعد التسخين 0.0712 mol من كلوريد الكوبلت الامائى ما صيغة هذا الملح المائى ؟ وما اسمه ؟
كتلة المركب كامل () قبل التسخين = 11.75 g
عدد المولات ما بقى من المركب بعد التسخين = 0.0712
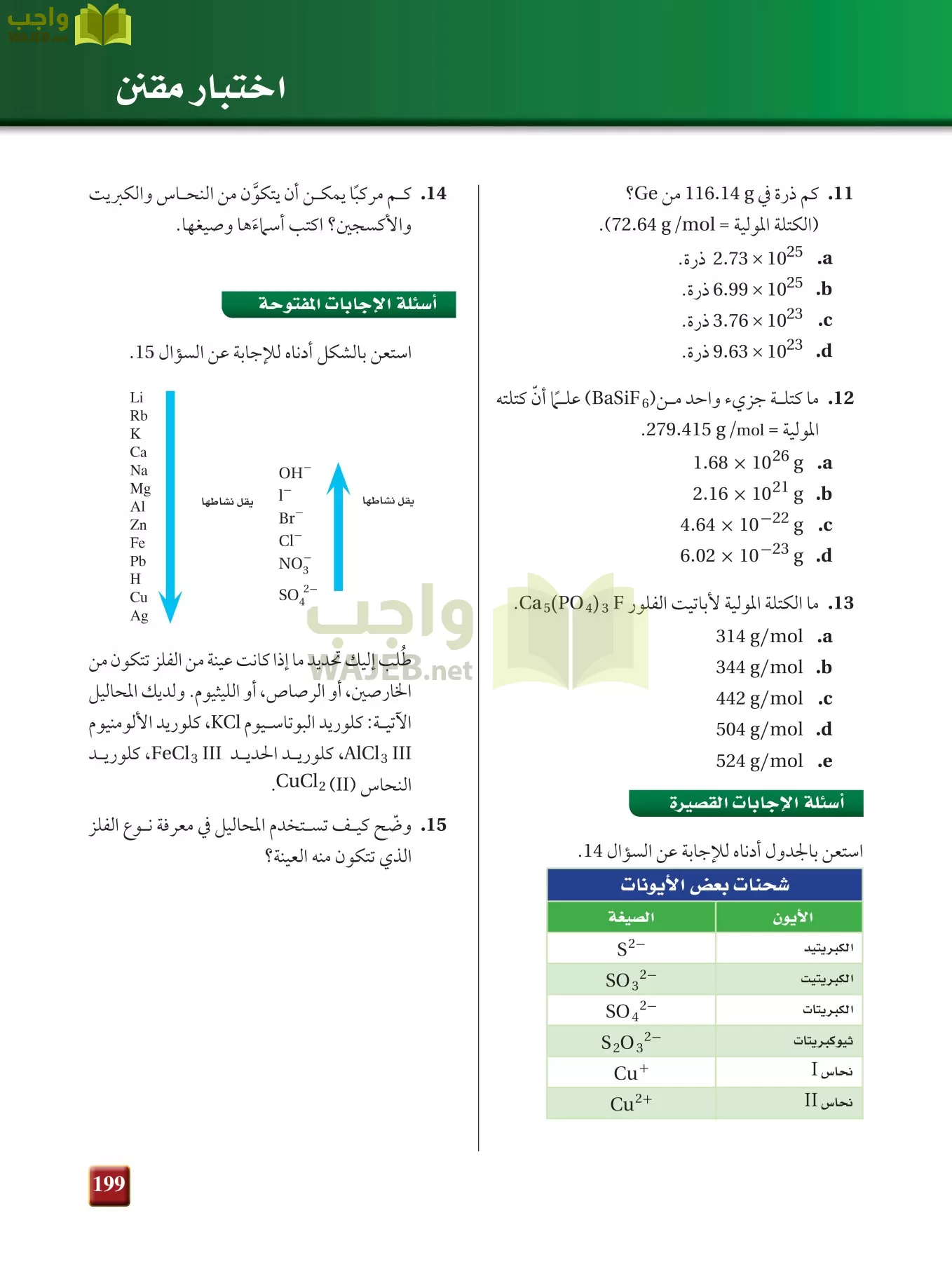
ومنه عدد الجرامات الموجودة فى 0.0712 منى = عدد المولات * الكتلة المولية =129.839*0.0712 =9.245 g
اذن كتلة الماء = 11.75-9.245=2.51 g
عدد المولات :
قسمة المولات الماء على مولات الملح =
تكتب صيغة الملح المائى :
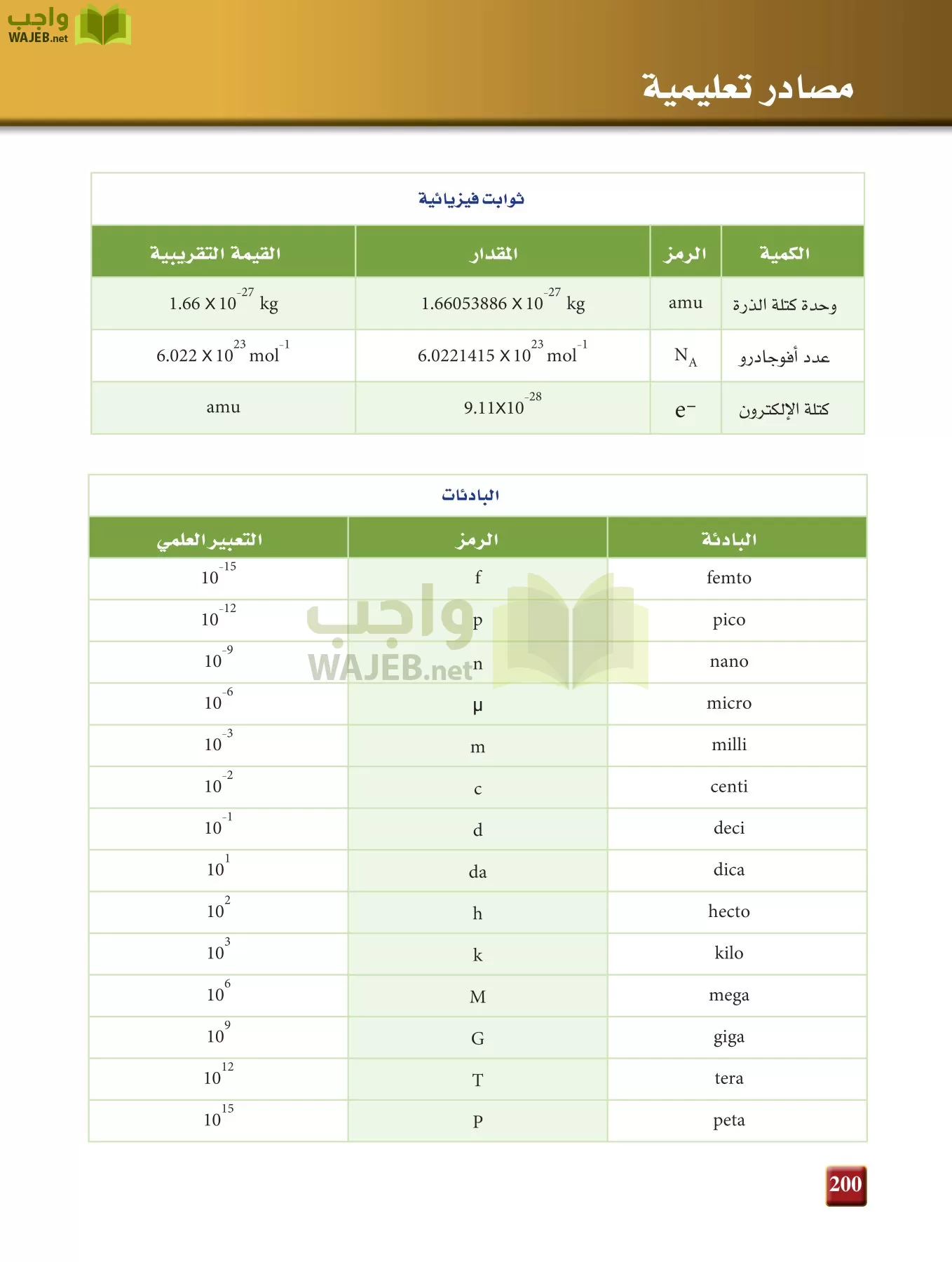
التقويم 5-5
76) وضح تركيب الملح المائى ؟
المركب المائى هو مركب ايونى احتجز جزيئات من الماء بداخله
77) سم المركب الذي صيغته
كلوريد الاسترانشيوم سداسي الماء
78)صف الخطوات العملية لتحديد صيغة الملح المائي معلا كل خطوة
نسجل كتلة جفنة فارغة ونضيف اليها مركبا مائيا ثم نعيد قياس كتلتها ونسخن الجفنة لاخراج الماء من المركب ثم نبرد الجفنة ونعيد قياس كتلتها ونحسب مولات الملح اللامائي ثم نطرح كتلة الجفنة بعد التسخين فيكون الفرق هو كتلة الماء المفقود ثم نحسب مولات الماء ونحسب اصغر نسبة عددية صحيحة مولات المركب الي الماء مما ينتج عنه صيغة المركب المائي
79) طبق يحتوى ملح مائى على من الماء لكل
0.00998 من المركب الايونى اكتب صيغة عامة للملح المائى .
. xY حيث تمثل XY المركب الايونى
80) احسب كتة ماء التبلور اذا فقد ملح مائى 0.025 MOL من الماء عند تسخينه
كتلة الماء فى الملح المائى :
81)رتب الاملاح المائية التالية تصاعديا بحسب تزايد النسبة المئوية للماء فيها :
نحسب الكتلة المولية ل
الكتلة المولية ل
الكتلة المولية ل
الكتلة المولية ل من
نحسب نسبة الماء في المركبات :
51.17% من في
45.70% من في
45.44% من في
82) طبق كيف يمكن استعمال الملح المائى فى الشكل 5-17 بوصفة طريقة تقريبية لتحديد احتمال سقوط المطر ؟
يصبح المركب المائى ورديا (زهريا) فى الهواء الرطب